ここから本文です。
ホーム > くらし・福祉・健康 > 健康・医療 > 医薬品・医療機器 > 医薬品 > 製造販売業・製造業・修理業関係について(医薬品・医療機器・医薬部外品・化粧品・体外診断用医薬品) > 医療機器等製造販売業・製造業の監視指導について
更新日:令和7(2025)年5月9日
ページ番号:3880
医療機器等製造販売業・製造業の監視指導について
医療機器、体外診断用医薬品(以下医療機器等と呼ぶ)製造販売業・製造業の監視指導に関するページです。
医療機器等製造販売業・製造業の業更新に係る調査
県では、医療機器等製造販売業・製造業の許可及び登録の更新時に許可基準(QMS体制省令/GVP省令)及び登録要件に適合していることを確認するため、更新に係る調査を実施します。平成25年11月27日に薬事法等の一部を改正する法律(法律第84号)が公布されたことに伴い、許可等制度が変更になったことから平成26年11月25日の施行日以降は当該ページに記載のとおり調査等を実施します。
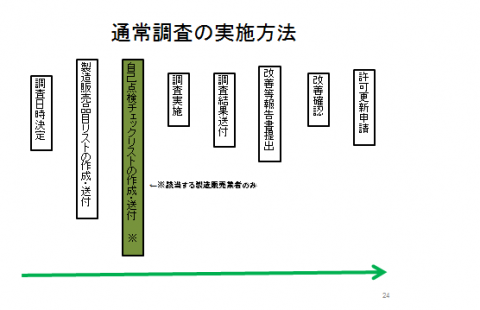
調査等の実施の流れについては概ね以下のとおりとなります。
(製造業)

登録更新申請書は登録期限日の概ね1か月前までに提出願います。
(製造販売業)
製造業の調査について
(当日の流れ)
- 会社及び製造所概要の説明
- 製造所ツアー(登録している場所の確認)
- 各種必要事項の確認
- 講評及び質疑応答
(用意していただくもの<例>)
- 製造品目一覧
- 登録している製造所の場所を明らかにした図面-配置図、平面図
- 製造フロー図※1
- 会社(製造所)概要
- QMS関連文書※1
- 製品標準書(作成している場合に限る)※1
- 製造指図/記録書※1
- 品質試験記録※1
- 出荷可否判定の記録※1
- 代表品目の現物(サンプル)※2
※1:クラス1届出品目のみ製造している場合確認予定。クラス2以上の品目を製造しており、QMS調査権者によって既に製造記録や品質マニュアル等の確認がされていることが明確な場合は原則として確認しません。なお更新に係る調査以外の特別調査の場合はその限りではありません。
※2:代表品目とはその製造所で製造される品目の製造工程を全て確認することができる主要製品のことです。製品特性等の違いにより、製造工程が著しく異なる製品を複数製造している場合は、その異なる製造工程ごとに1~2製品代表品目を選定していただく場合があります。製造記録や製品標準書の確認は原則として代表品目のみ実施します。
製造販売業の調査について
(当日の流れ)
- 会社(事業所)概要の説明
- QMS体制省令/GVPに関する文書類、記録の確認
- 講評及び質疑応答
(用意していただくもの)
- 会社概要
- QMS適合状況自己点検チェックリスト(エクセル:41KB)※
QMS適合状況自己点検チェックリスト(PDF:282.8KB) - QMS体制/GVP手順書等
- QMS体制/GVP記録類等
- 代表品目の現物(サンプル)
- 製造販売承認書の写し(製造販売届書の写し)※
※QMS適合状況自己点検チェックリストはクラス1届出品目のみを製造販売している医療機器等製造販売業者を対象として品質管理監督システムの全般(限定一般医療機器については該当する部分のみ)について自主的な点検を実施していただき、適合状況を確認するものです。調査時に内容について確認する場合がありますので、対象となる製造販売業者は調査当日までに記入を完了しておくようにしてください。なお、記入様式については調査日時決定後、当課より送付いたします。
新法移行により、平成26年11月25日以降は原則として全ての医療機器等製造販売業者にQMS省令が適用されるようになり、当該省令に基づいた品質管理監督システムの確立及び品質管理監督システム基準書(品質マニュアル)の作成等が医療機器等製造販売業者に求められるようになりました。品質マニュアルの作成例については次のページを参考にしてください。
事前提出資料について
調査を受ける1週間前を目安に、以下の資料を薬務課監視指導班宛てご提出ください。
(提出先;メール:kusuri5(アットマーク)mz.pref.chiba.lg.jp、ファックス:043-227-5393)
<製造販売業>
製造販売品目表様式(エクセル:17KB)
製造販売品目表様式(PDF:43.7KB)記載例(PDF:74.3KB)
QMS/GVP管理体制図(ワード:30.5KB)
QMS/GVP管理体制図(PDF:61.8KB)
<製造業>
製造品目表(ワード:15KB)
製造品目表(PDF:128.2KB)
調査実施後の改善等報告について
調査実施後、指摘事項があった場合は、製造業の単独調査については調査日から概ね2週間以内に、製造販売業(併せて製造業を実施する場合も含む。以下同じ。)については後日送付される文書に記載されている期日までに、薬務課へ直接来庁の上、改善等報告をお願いします。なお、ご来庁の際には事前に担当にアポイントを取ってくださるようお願いします。
当課への改善報告に使用する報告書の様式は以下のとおりです。
- 製造業
(改善等報告書様式1,2)(ワード:52KB)
(改善等報告書様式1,2)(PDF:54.9KB) - 製造販売業
(改善等報告書様式1,2)(ワード:54KB)
(改善等報告書様式1,2)(PDF:55.9KB)
製造業については、登録期限満了日までに改善報告を完了させてください。
製造販売業については、以下の通知に基づきQMS体制省令及びGVP省令に関する適合性確認を実施します。
- 平成26年9月11日薬食監麻発0911第1号厚生労働省医薬食品局監視指導・麻薬対策課長通知
医療機器又は体外診断用医薬品の製造管理又は品質管理に係る業務を行う体制の基準に関する省令について(PDF:304KB) - 平成26年9月30日薬食安発0930第2号厚生労働省医薬食品局安全対策課長通知
医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する適合性評価ついて(PDF:773KB)
許可(登録)更新申請について
医療機器等製造販売業の場合は、改善が完了又は許可基準の総合評価が適合となった場合は、許可期限満了日の概ね1か月前を目安に更新申請を行ってください。
医療機器等製造業単独調査の場合は、原則として、登録更新申請書提出後に実地調査を実施します。
許可(登録)更新申請方法の詳細については、以下のページを参照してください。
医療機器及び体外診断用医薬品製造販売業の許可更新申請について
お問い合わせ
より良いウェブサイトにするためにみなさまのご意見をお聞かせください
