ここから本文です。
更新日:令和8(2026)年1月7日
ページ番号:3892
医薬品等製造業・製造販売業の監視指導について
医薬品(体外診断用医薬品を除く)、医薬部外品、化粧品(以下、「医薬品等」と呼ぶ)製造販売業・製造業(GMP/QMS調査を除く)の監視指導に関するページです。
医薬品等製造業・製造販売業の業許可更新に係る調査
千葉県では医薬品等製造業・製造販売業の許可の更新時に許可基準(薬局等構造設備規則、GQP/GVP省令)に適合していることを確認するため、更新に係る調査を実施しています。業許可を更新するためには事前に調査を受けて、製造所の製造管理及び品質管理体制及び事業所の品質保証業務や製造販売後安全管理業務に不備がないことを確認しておく必要があります。
調査を実施する際は、まず当課担当者が電話等で連絡して、調査日時等を決定します。その後の調査実施前から実施後の流れについては以下の図を参考にしてください。
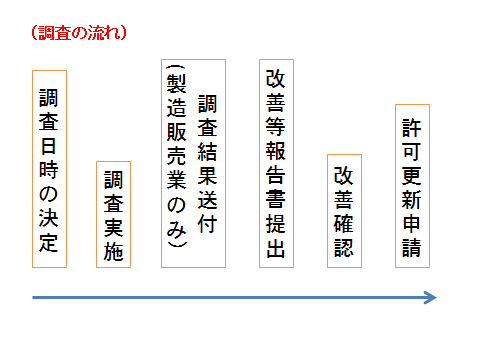
※以下にも記載がありますが、医薬品等製造販売業等の許可更新申請は期限日の概ね一カ月前を目安に申請してください。
調査当日の流れについて
(製造業調査)
- 会社及び製造所概要の説明
- 製品(代表品目※)概要説明
- 製造所ツアーの事前確認
- 製造所ツアー
- 文書、記録類の確認
- 調査実施者の内部打ち合わせ
- 講評及び総合質疑応答
(製造販売業)
- 会社概要の説明
- 製品(代表品目※)概要説明
- GQP/GVPに関する文書類、記録の確認
- 調査実施者の内部打ち合わせ
- 講評及び総合質疑応答
※代表品目とはその製造所で製造される品目の製造工程を全て確認することができる主要製品のことです。剤形等の違いにより、製造工程が著しく異なる製品を複数製造している場合は、その異なる製造工程ごとに1~2製品代表品目を選定していただきます。製造記録や製品標準書の確認は原則として代表品目を中心に実施します。調査当日までに代表品目を選定していただきますようお願いします。
調査時に用意する物
(製造業)
- 製造品目一覧
- 施設平面図
- 製造フロー図
- 会社概要
- 製品(品質)標準書(作成している場合に限る)
- 製造指図/記録書
- 品質試験記録
- 出荷可否判定の記録
- 代表品目の現物(サンプル)
(製造販売業)
- 製造販売品目一覧
- 会社概要
- 品質(製品)標準書(作成している場合に限る)
- GQP/GVP手順書等
- GQP/GVP記録類
- 出荷可否判定の記録
- 代表品目の現物(サンプル)
- 製造販売承認書の写し(製造販売届の写し)
- 製造業者との取決め書(作成している場合に限る)
調査実施後の改善等報告について
更新調査を実施後、指摘事項があった場合は、製造業については、監視指導票を現場で交付後、概ね2週間以内に、製造販売業に関しては後日送付される公文書に記載されている日付までに、薬務課へ直接来庁の上、指摘事項に関して改善等報告を行なってください。なお、改善報告に来られる際には事前に担当者へ連絡を取っていただくようお願いします。
当課への改善報告に使用する報告書の様式は以下のとおりです。
- 製造業
(改善等報告書様式1,2)(ワード:53KB)
(改善等報告書様式1,2)(PDF:28.2KB) - 製造販売業
(改善等報告書様式1,2)(ワード:54KB)
(改善等報告書様式1,2)(PDF:28.8KB)
製造業については、許可期限満了日までに発出された指摘事項の改善を全て完了させてください。
製造販売業については、以下の2通知によりGQP/GVPに関する適合性評価を行うので、それに基づき、適切に改善措置を実施するようにしてください。
- 平成17年3月30日付け薬食監麻発第0330001号厚生労働省医薬食品局監視指導・麻薬対策課長通知
薬事法及び採血及び供血あつせん業取締法の一部を改正する法律の施行に伴う医薬品、医療機器等の製造管理及び品質管理(GMP/QMS)に係る省令及び告示の制定及び改廃について(PDF:737KB) - 平成26年9月30日付け薬食安発0930第2号厚生労働省医薬食品局安全対策課長通知
医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する適合性評価について(PDF:773KB)
指摘事項の取扱い方(参考)
- 軽度の不備事項
改善結果報告書又は具体的な改善計画書を提出してください。 - 中程度の不備事項
改善結果報告書又は具体的な改善計画書を提出してください。なお、計画で提出した場合は、許可期限満了日までに未完了の改善を完了させ、改善結果報告書を提出してください。 - 重度の不備事項
速やかに改善が完了する見込みがある場合に限り、措置の実施確認後、中程度の不備事項と同様に取り扱います。それ以外の場合は原則不適合となります。
改善等報告終了後
医薬品等製造業・製造販売業の前倒し調査が終了し、その結果適合となった後は、許可期限満了日の概ね1か月前を目安に医薬品等製造業・製造販売業許可更新申請を忘れずに行ってください。許可更新申請については以下のページを参照してください。
医薬品、医薬部外品、化粧品製造業及び医療機器修理業の許可更新申請について
お問い合わせ
より良いウェブサイトにするためにみなさまのご意見をお聞かせください
